在密闭容器中进行如下反应:X2(g)+Y2(g)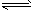 2Z(g), 已知X、Y、Z的起始浓度分别为0.1mol/L、 0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g), 已知X、Y、Z的起始浓度分别为0.1mol/L、 0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
[ ]
A.Z为0.3mol/L B.Y为0.4mol/L C.X为0.2mol/L D.Z为0.4mol/L
相关问题推荐
-
T℃时,将3molA和1molB气体通入体积为2L的密闭容器(体积不变),发生反应:
3A(g)+B(g)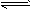 xC(g)。2min后达平衡,剩余0.8molB,C的浓度为0.4mol/L。
xC(g)。2min后达平衡,剩余0.8molB,C的浓度为0.4mol/L。
(1)x=______;
(2)若向平衡混合物中通入少量He,则平衡_____(填“正向移动”、“逆向移动”或“不移动”)
(3)若向平衡混合物中再充入amol C,在T℃时达新平衡,此时B的物质的量为______(用含a的式子表示):
(4)若上述反应在相同温度和容器中进行,欲使反应达平衡时c的物质的量分数与原平衡相等,则起始加入三种物质的量n (A)、n (B)、n (C)间应满足的关系式为______。 -
近年来,中国与非洲国家的关系迅速发展,特别是中国对非洲的投资明显增多,以致起引了某些西方人士的非议,甚至荒唐地认为中国在非洲推行新的“殖民政策”。
结合材料,从主权国家的角度,驳斥“中国在非洲推行新的‘殖民政策”’这一言论。 -
恒温下,将amol N2和bmol H2的混合气体通入一固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)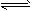 2NH3(g),
2NH3(g),
(1)若反应进行到某时刻t时刻,n(N2)=13mol,n(NH3)=6mol,计算a的值
(2)反应达到平衡时,混合气体的体积为716.8L(标况),其中NH3的含量为25%(体积分数),则平衡时n(NH3)=?
(3)原混合气体与平衡时混合气体的总物质的量之比n(始):n(平)=?
(4)原混合气体中,a:b=?
(5)达到平衡时,N2和H2的转化率之比为多少?
(6)平衡混合气体中,n(N2) :n(H2): n(NH3)=? -
反应CO(g)+H2O(g)
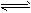 CO2(g)+H2(g)ΔH=-41.2kJ·mol-1,在800℃时的化学平衡常数K=1.0。某时刻测得该温度下的密闭容器中各物质的物质的量见下表
CO2(g)+H2(g)ΔH=-41.2kJ·mol-1,在800℃时的化学平衡常数K=1.0。某时刻测得该温度下的密闭容器中各物质的物质的量见下表
此时反应中正、逆反应速率的关系式是
[ ]
A.v(正)>v(逆)B.v(正)<v(逆)C.v(正)=v(逆)D.无法判断
-
定条件下,存在可逆反应X(g)+2Y(g)
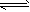 3Z(g),若X、Y、Z起始浓度分别为
3Z(g),若X、Y、Z起始浓度分别为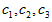 (均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.2mol/L,0.06mol/L,则下列判断不合理的是
(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.2mol/L,0.06mol/L,则下列判断不合理的是[ ]
A.
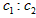 =l:2B.达平衡状态时,生成Z的速率是生成X速率的3倍C.X、Y的转化率不相等D.C2的取值范围为
=l:2B.达平衡状态时,生成Z的速率是生成X速率的3倍C.X、Y的转化率不相等D.C2的取值范围为
