恒温、恒压下,在一可变容器下反应,A(g) + B(g)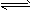 C(g)
C(g)
(1)开始时,放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的量为_________mol
(2)若开始时放入3mol
A、3molB,到达平衡后生成C的物质的量为______mol
(3)若开始时,放入Xmol
A、2molB和1molC,到达平衡后,A和C的物质的量分别是Ymol和3amol,
则X=___\_,Y=____
(4)若在(3)的平衡状态上再加入3molC,待再次平衡后,C的物质的量分数是____
相关问题推荐
-
T℃时,将3molA和1molB气体通入体积为2L的密闭容器(体积不变),发生反应:
3A(g)+B(g)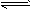 xC(g)。2min后达平衡,剩余0.8molB,C的浓度为0.4mol/L。
xC(g)。2min后达平衡,剩余0.8molB,C的浓度为0.4mol/L。
(1)x=______;
(2)若向平衡混合物中通入少量He,则平衡_____(填“正向移动”、“逆向移动”或“不移动”)
(3)若向平衡混合物中再充入amol C,在T℃时达新平衡,此时B的物质的量为______(用含a的式子表示):
(4)若上述反应在相同温度和容器中进行,欲使反应达平衡时c的物质的量分数与原平衡相等,则起始加入三种物质的量n (A)、n (B)、n (C)间应满足的关系式为______。 -
CH3OH(g)+H2O(g)
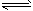 CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题: (1)在其它条件不变的情况下降低温度,则逆反应速率___\_(填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率______。 (2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为________。 (3)判断该可逆反应达到平衡状态的依据是(填序号)________。 A v正(CH3OH)=v正(CO2) B 混合气体的密度不变 C 混合气体的平均相对分子质量不变 D CH3OH.H2O.CO2.H2的浓度都不再发生变化 (4)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方向移动的是 ________(填序号)。 A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 F.移出水蒸气 (5)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2mol H2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL。试回答:
CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题: (1)在其它条件不变的情况下降低温度,则逆反应速率___\_(填“增大”或“减小”或“不变”,下同);在其它条件不变的情况下加压,则正反应速率______。 (2)一定条件下,向体积为2L的密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为________。 (3)判断该可逆反应达到平衡状态的依据是(填序号)________。 A v正(CH3OH)=v正(CO2) B 混合气体的密度不变 C 混合气体的平均相对分子质量不变 D CH3OH.H2O.CO2.H2的浓度都不再发生变化 (4)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方向移动的是 ________(填序号)。 A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 F.移出水蒸气 (5)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2mol H2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL。试回答: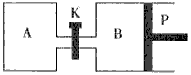
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为______,A.B两容器中H2O(g)的体积百分含量的大小关系为:B______(填“>”.“<”.“=”) A。 ②若打开K,一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
-
恒温下,将amol N2和bmol H2的混合气体通入一固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g),
2NH3(g),
(1)若反应进行到某时刻t时刻,n(N2)=13mol,n(NH3)=6mol,计算a的值
(2)反应达到平衡时,混合气体的体积为716.8L(标况),其中NH3的含量为25%(体积分数),则平衡时n(NH3)=?
(3)原混合气体与平衡时混合气体的总物质的量之比n(始):n(平)=?
(4)原混合气体中,a:b=?
(5)达到平衡时,N2和H2的转化率之比为多少?
(6)平衡混合气体中,n(N2) :n(H2): n(NH3)=? -
已知工业制氢气的反应为CO(g)+H2O(g)
 CO2(g)+H2(g),反应过程中能量变化如图所示。在500 ℃时的平衡常数K=9。若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态。
CO2(g)+H2(g),反应过程中能量变化如图所示。在500 ℃时的平衡常数K=9。若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态。 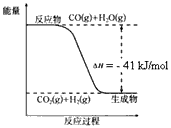
(1)增加H2O(g)的浓度,CO的转化率将_____(填“增大”“减小”或“不变”)。 (2)平衡常数的表达式K=___\_。400℃时的平衡常数K_______9(填“>”“<”或”“=”)。 (3)500℃时,10min内v(H2O)=___\__,在此过程中体系的能量将____\_(填“增加”或“减少”)________kJ。 (4)已知2H2(g) + O2(g) = 2H2O(g) ΔH=-484kJ/mol 结合上图写出CO完全燃烧生成CO2的热化学方程式:___________。
-
反应CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH=-41.2kJ·mol-1,在800℃时的化学平衡常数K=1.0。某时刻测得该温度下的密闭容器中各物质的物质的量见下表
CO2(g)+H2(g)ΔH=-41.2kJ·mol-1,在800℃时的化学平衡常数K=1.0。某时刻测得该温度下的密闭容器中各物质的物质的量见下表
此时反应中正、逆反应速率的关系式是
[ ]
A.v(正)>v(逆)B.v(正)<v(逆)C.v(正)=v(逆)D.无法判断
