工业废水中常含有一定量的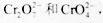 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为 
其中第①步存在平衡: 
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr O
O
 和CrO
和CrO 的浓度相同
的浓度相同
b.2v (Cr O
O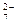 ) ="v" (CrO
) ="v" (CrO )
)
c.溶液的颜色不变
(3)第②步中,还原1mol Cr O
O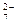 离子,需要 mol的FeSO
离子,需要 mol的FeSO ·7H
·7H O。
O。
(4)第③步生成的Cr(OH) 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡: 
常温下,Cr(OH) 的溶度积
的溶度积 ,要使c(Cr3+)降至10
,要使c(Cr3+)降至10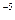 mol/L,溶液的pH应调至 。
mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr O
O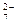 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH) 沉淀。
沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
相关问题推荐
-
恒压密闭容器中充入2 mol X和5 mol Y,发生反应:X(g)+3Y(g)
 2Z(g),温度分别为T1和T2时,X的转化率α(X) 随时间变化的关系如图。下列结论正确的是
2Z(g),温度分别为T1和T2时,X的转化率α(X) 随时间变化的关系如图。下列结论正确的是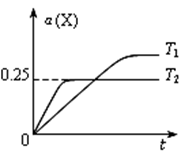
A.该反应正反应吸热
B.达到平衡后,其它条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,其它条件不变,降低温度,正逆反应速率均减小,Z的体积分数也减小
D.在T2℃时,若开始加入1molX、3molY和2molZ,达到平衡后α(X)>0.25
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)
 2C(g),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,下列几种说法中不正确的是:
2C(g),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,下列几种说法中不正确的是:A.用物质 A 表示的反应的平均速率为 0.3 mol∕(l·s)
B.用物质 B 表示的反应的平均速率为 0.3 mol∕(l·s)
C.2 s 时物质 A 的转化率为30%
D.2 s 时物质 B 的浓度为 0.7 mol∕l
-
在容积可变的密闭容器中,2mol
 和8mol
和8mol 在一定条件下反应,达到平衡时,
在一定条件下反应,达到平衡时, 的转化率为25%,则平衡时氨气的体积分数接近于
的转化率为25%,则平衡时氨气的体积分数接近于A.5%
B.10%
C.15%
D.20%
-
在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度mol·L-1
20
40
60
80
100
c(N2O4)mol·L-1
0.100
c1
0.050
c3
a
b
c(NO2)/mol·L-1
0.000
0.060
c2
0.120
0.120
0.120 试填空:
(1)达到平衡时N2O4的转化率为 %,表中c2 c3,a b (选填“>”“<”“=”)。 (2)20s的四氧化二氮的浓度c1= mol·L-1,在0s~20s内四氧化二氮的平均反应速率为 mol·(L·s)-1;。 (3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。
-
对于在一定条件下密闭容器中进行的反应N2+3H2
 2NH3,下列有关推断正确的是
2NH3,下列有关推断正确的是A.3molH2与足量的N2在该容器内充分反应可生成2molNH3
B.当生成N2和NH3的速率之比为1:2时反应处于平衡状态
C.在相同的温度和压强下,与不使用催化剂相比,使用催化剂可以提高平衡混合物中NH3的含量
D.当反应速率之比_v_(N2):_v_(H2):_v_(NH3)=1:3:2时,反应处于平衡状态
